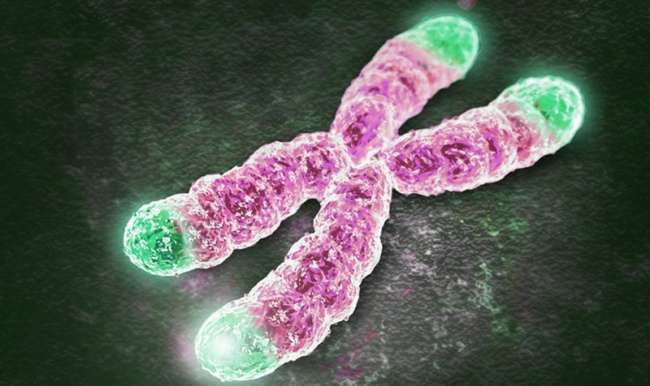
Gençlerde telomer uzunluğu 8,000-10,000 nükleotite kadar olabiliyor. Her hücre bölünmesinde bunlar kısalıyor, ve kritik uzunluğa ulaştığında hücre bölünmesi duruyor ve hücreler ölmeye başlıyor. Hücrelerin iç saati nedeniyle laboratuvar ortamında hücrelerin canlı tutulması oldukça zor. Ancak birkaç hücre bölünmesi gerçekleşebiliyordu. Hücre İçi Saati Geriye Kurmak Artık insan telomerlerinin 1000 nükleotite kadar uzatmanın yolunu buldukhücre saatleri bu şekilde geriye almak insan ömründe pek çok yıla denk geliyor. Bu sayede ilaç testleri veya hastalık modelleme çalışmaları için hücre sayısı büyük ölçüde artıyor, diyor Stanforddan mikrobiyoloji ve immünoloji Prof. Dr. Helen Blau . Araştırmacılar modifiye mesajcı RNA kullanarak telomerleri uzattılar. DNAdaki genlerden aldığı bilgileri hücrelerin protein fabrikalarına taşıyan RNAlar bu deneyde önemli rol taşıyor. Deneydeki RNAlarda kodlama sekansı için TERT adı verilen doğal olarak telomeraz enzimi içeren aktif bir içerik kullanılıyor.
Kök hücreler tarafından tanımlanan telomeraz enzimi sperm ve yumurta hücrelerini meydana getirerek bu hücrelerin tam şeklinin bir sonraki nesle aktarılmasını güvence altına alıyor. Buna rağmen, diğer hücre türlerinde çok az düzeyde telomeraz enzimi tanımlanıyor. Geçici Etkinin Avantajı Yeni geliştirilen tekniği bir diğer önemli avantajı ise diğer potansiyel metotlara göre geçici olması . Modifiye RNA hücrenin tedaviye bağışıklık cevabını azaltmak için tasarlanıyor ve TERT şifrelenen mesaj modifiye olmayan mesajda biraz daha uzun tutunuyor. Fakat 48 saat sonunda harcanarak yok oluyor. Sonrasında ise uzayan telomerler sonrasında progresif bir şekilde hücre bölünmesi ile tekrar kısalıyor.
Biyolojik açıdan tedavi edilen hücreler böylece sonsuza kadar bölünmüyor, bu zaten insanlarda kanser riski taşıyacağından çok tehlikeli. Araştırmacılar modifiye mRNAnın birkaç muhtemel uygulamasını buldular. 1000 nükleotit eklemek insan telomerlerinin % 10 daha fazla artışını temsil ediyor. Petri kabında bölünen cilt hücrelerinin 28, kas hücrelerinin ise 3 kez daha fazla bölündüğü anlaşıldı. Modifiye TERT mRNAnın çalıştığını görünce gerçekten şaşırdık ve memnun olduk. Çünkü TERT çok düzenleyici olduğundan diğer bir telomeraz bileşiğine bağlanmakta zorundadı.
Daha önceki mRNA kodlanmış TERT denemeleri telomeraza karşı bir bağışıklık geliştirerek kaldırıcı bir etki yarattı. Buna karşın yeni metot nonimmünojenik. Mevcut geçici telomer uzatıcı etkiler oldukça yavaş çalışıyor ,fakat bizim metotumuz sadece birkaç gün içinde telomer kısalmasını geriye çevirererek, nerdeyse on yıllık normal bir yaşlanma getiriyor. Bu da yeni tedavimizin kısa ve sürekli olmayacağını gösteriyor, diyor Ramunas. Tedavinin Potansiyel Kullanım Alanları Yeni yaklaşımımız yaşlanmaya ilişkin hastalıkları tedavi etmenin veya önlemenin yolunu açıyor. Telomer kısalmasıyla ilişkili elden ayaktan düşüren genetik hastalıklar için potansiyel bir tedavi olabilir, diyor Blaus. Blau ve meslektaşları daha önce,Duchenne müsküler distropisi adı verilen erkek çocuklarında kas kök hücrelerinin telomer uzunluğunun daha kısa olduğunu göstermişti. İşte bu bulgunun sadece hücrelerin fonksiyonunu anlamaya değil yeni kaslar üretmede neden fonksiyonel olmadığını ve laboratuar çalışmalarında neden etkilenen hücrelerin kısıtlı bir kabiliyeti olduğunu gösteriyor. Araştırmacılar şimdi diğer hücre tiplerinde yeni tekniği test ediyorlar.
Tedavinin yaşlanmaya ilişkin genetik hastalıklar, kalp ve diyabet gibi hastalıklar üzerine potansiyel tedavi yöntemleri üretebileceği düşünülüyor. Bu çalışma telomer uzamasının geliştirilmesin ilişkin birinci adımı temsil ederken, hücre terapilerini geliştirerek, muhtemel hızlanmış yaşlanma bozukluklarını tedavi etmeyi amaçlıyor, diyor Stanfordda önceden Kardivasküler Tıp Uzmanı Prof. Dr. John Cooke. Bugün Houston Methodist Araştırma Enstitüsünde kardivasküler bilimlere başkanlık yapıyor.
Kaynak










![Uzay Çalışmalarının Önemi - Süleyman Fişek [Röportaj] Uzay Çalışmalarının Önemi - Süleyman Fişek [Röportaj]](https://fizikist.com/uploads/img/uzay-calismalarinin-onemi.jpg)
![Saatte 333 km hızla giden roketli bisiklet [Video]](https://fizikist.com/uploads/img/88619032015163419.jpg)



0 yorum