
Doğrusu, parçacık hızlandırıcılarının çok azı nükleer fizik veya parçacık fiziği için kullanılmakta olup çoğunun büyüklüğü de bir kaç metreyi geçmemekte. Hızlandırıcılar kanser tedavisi, savunma sanayi, yarı-iletken üretimi, uzaya gönderilecek uydu ve roketlerin radyasyon hassasiyetlerin belirlenmesi, uçak kanatları gibi sağlamlık gerektiren çeşitli materyallerin dayanıklılık ve mikro çatlak içerip içermediklerinin belirlenmesi gibi bir çok uygulama alanına sahip. Belki de hızlandırıcıya sahip en çarpıcı kurum Louvre müzesidir (Resim 2); müzenin meşhur cam piramidinin 15 metre altında bulunan proton hızlandırıcısı, antikaların ve tabloların içerdikleri element ve mineralleri belirlemede kullanılıyor [2]. Arkeoloji dışında, hızlandırıcı kullanan akla hemen gelmeyen bir diğer bilim alanı ise biyoloji. Bu alanda kullanım sebeplerinden en önemlisi proteinlerin yapısını anlamak. Yani parçacık hızlandırıcıları için fizikçilerin tasarlayıp, kendilerinin oynamak için çok şans bulamadıkları aletler desek yeridir.

Resim 2- Louvre Müzesi
Atomun yapısını anlayıp; evrenin ilk anlarına bizi götüren parçacık hızlandırıcıları, nasıl oluyor da biyoloji, metalürji ve materyal biliminde de kullanılabiliyor? Bu soruya yanıt verebilmek için lisedeki ışık mikroskobunun nasıl çalıştığını hatırlamakta fayda var. Işık mikroskopu, incelenecek materyal, doku veya hücrenin altından gözümüze doğru bir ışık veriyor, ve şeffaf dokudan geçen ışık merceklerle gözümüze büyütülerek algılayabileceğimiz hale geliyor. Tabi bu yöntemle görebileceğimiz şey -merceğin büyütüp- gözümüzün algılayabileceği miktarı pek geçemiyor ne yazık ki. Oysaki ışığın spektrumunda (tayfında) ‘görülebilir ışık’ çok çok küçük bir kısmı kapsıyor, yani gözümüzün göremediği radyo dalgaları, x ve gama ışınları gibi çok daha geniş bir spektrum var (bkz. Resim 3).
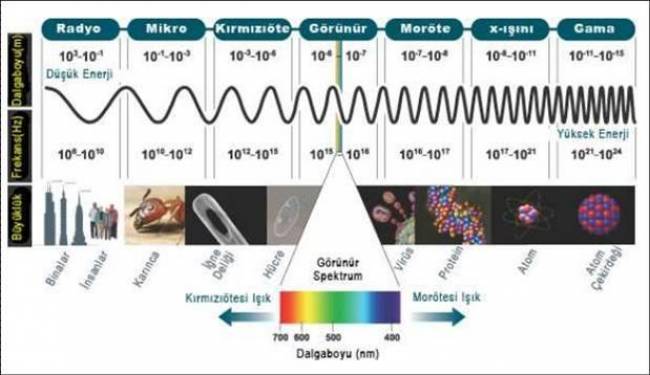
Resim 3 - Elektromanyetik Tayf (Spektrum) [3]
Yine lisede öğrendiğimiz 2 ilkeyi hatırlayalım:
i) Dalganın enerjisi arttıkça dalga boyu küçülür.
ii) Parçacık hem maddedir hem de dalga.
Öyleyse dalganın (bir diğer deyişle parçacığın) enerjisini artırarak daha küçük şeyleri -deyim yerindeyse- görebiliriz. İşte hızlandırıcılar gözle göremediğimiz ama (algıçlarla) detektörlerle “görülebilen/algılanabilen” x-ışınlarını, incelemek istediğimiz çeşitli protein veya materyallere gönderip oluşan saçılmalar ve girişimlerden onların yapısını; içerdikleri moleküllerin birbirine nasıl bağlandığını 3 boyutlu olarak çözümlüyor [4]. Özetle, bir arkeolojik kazı sırasında bulduğunuz bir metalin ne kadarının değerli madenlerden oluştuğunu belirleyebilir veya bir proteinin içerisindeki aminoasitleri ve bağlarını görüntüleyebilirsiniz.
Peki ya kanser tedavisi? En basit haliyle açıklamak istersek, kinetik enerjisini artırdığımız yani hızlandırdığımız parçacıklarımızı (elektron, proton veya ağır iyon) kanserli hücrelere çarptırıp, onların DNA’larına zarar verip onların kendilerini yenilemelerini engelleyeceğiz, -deyim yerindeyse- onları ölüme terkedeceğiz. Şimdi “kanser ya sağlıklı hücrelerle çevrelenmişse” dediğinizi duyar gibiyim. Belki de parçacıkların doğasının en güzel özelliği, enerjileriyle doğru orantılı olarak maddenin içinde ilerleyip yollarına devam etmeleridir. Şöyle ki enerjisi bitine kadar maddenin içinde ilerleyip çevresiyle pek etkileşime girmeyen parçacık, enerjisi bitince o bölgede bulunan hücre tarafından emilip hücrenin içinde yok oluyor ve doğal olarak kabul edildiği kanserli hücreye çok büyük zarar veriyor (bkz. Proton ve Ağır İyon için Bragg Eğrisi [5]). Yani özetle işimiz: kanserin 3 boyutlu şeklini ve yerini bulup, parçacıkları tam olarak kanser hücrelerinin olduğu yerde duracak enerji ve yoğunlukta göndermek. Resim 4’te verilen örnekte beynin ortasında bulunan tümöre hızlandırıcının oluşturduğu radyasyon/parçacık farklı açılardan maruz bırakılmış, en fazla radyasyon 3 boyutlu olarak kanser hücrelerine verilmiş. Uzun bir süreç halinde 15-20 seansta uygulanan bu terapi, hastanın sağlıklı beyin hücrelerine çok az zarar verirken, kanser hücrelerinin nerdeyse tamamını etkisiz hale getiriyor.
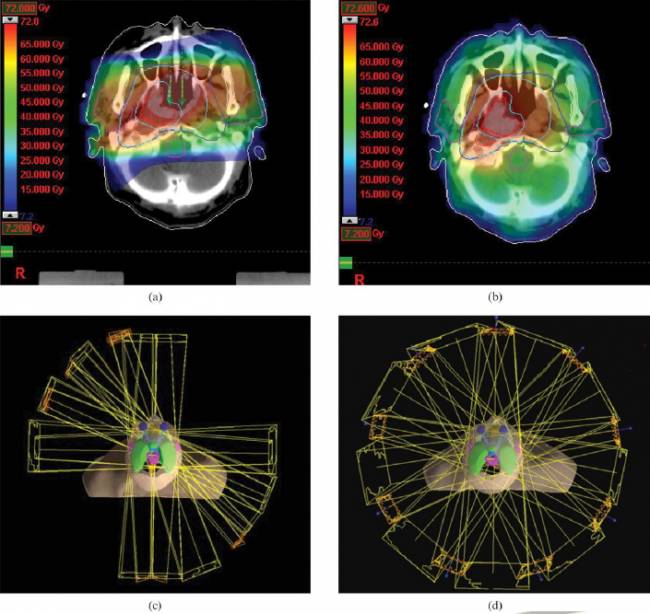
Resim 4 - (a) ve (b) beyine gönderilen radyasyon dozajı tümörün olduğu yerde en yüksek seviyeye gelmiş. (c) ve (d) radyasyonun verildiği açılar değiştirilerek tümörün olduğu yere 3 boyuttan da ulaşıp, sağlıklı hücrelere en az zarar verilmesi amaçlanmış [6].
Hızlandırıcılar daha aklımızın ucundan geçmeyecek bir çok alanda kullanılıyor: bir bilgisayar çipini üretmekten, fabrikaların baca gazlarından zirai gübre elde edip havayı daha az kirletmelerini sağlamaya kadar, uçuk ve geniş bir alan. Belki bunlara gelecekteki yazılarda değiniriz.
Sonuç olarak, her şey kelime anlamı bölünemez olan atomun bölünebilmesiyle başladı. Sonrasında hızlandırıcılarla, atomun içine fersah fersah bir yolculuk fırsatı bulduk ve bu yolculuğun her durağında bambaşka teknolojik uygulamalar keşfettik. Evreni anlamak adına, maddeyi neyin var ettiğini araştırırken interneti bulduk mesela... ve şuan bu sayede bu yazıyı okuyorsunuz. Zaten bilim denilen bu anlama ve merak aşkının meyvesi hep teknoloji oluyor. Hatta, belki de bir his’le başlayıp, son kertede insana en çok yarar sağladığı için bilime aşk deniyor.
23-04-2016
Cenevre, İsviçre
Referanslar
[1] Accelerators for Americas Future Report, pp. 4, DoE, USA, 2011
[2] http://www.symmetrymagazine.org/article/may-2015/the-accelerator-in-the-louvre
[3] https://www.hvkk.tsk.tr/portals/0/Goruntuler/uydu2.jpg?ver=2015-10-08-113300-403
[4] https://www.jic.ac.uk/staff/david-lawson/xtallog/summary.htm
[5] http://heavy-ion.showa.gunma-u.ac.jp/en/page.php?id=8
[6] Dr. Suzie Sheehy, Applications of Accelerators, CERN Introductory Accelerator School; Prague, 2014










![Uzay Çalışmalarının Önemi - Süleyman Fişek [Röportaj] Uzay Çalışmalarının Önemi - Süleyman Fişek [Röportaj]](https://fizikist.com/uploads/img/uzay-calismalarinin-onemi.jpg)




0 yorum